一份CFDA通告
近年来,国家食品药品监管系统飞行检查的力度逐年加大。所谓飞行检查,就是在不提前通知、企业没有准备的情况下,药监人员突击检查,发现企业最真实的情况。经过飞检,2017年共收回及注销医药企业的GMP证书128张,在新年钟声敲响之前的12月28日,国家食品药品监督管理总局(CFDA)签署了最后一个处罚通告,措辞严厉地罗列了两家药企——广西大海阳光药业有限公司(原北海阳光药业有限公司)和福建汇天生物药业有限公司的违法违规行为:
一、广西大海阳光药业有限公司(原北海阳光药业有限公司)2016年11月其最后购进的一批硫酸庆大霉素原料药(批号:1404030,长治中宝制药有限公司生产),因物料发放失误用于生产,发现后未及时采取纠正措施,套用之前已检验合格的烟台只楚药业有限公司生产的硫酸庆大霉素原料药(批号:160610265)伪造烟台只楚药业有限公司的400个十亿单位的增值税发票、留样记录、出入库台账、检验报告单、4批硫酸庆大霉素片(批号:161103、161104、161105、161106)的批生产记录等一系列票据及记录。经抽样检验,目前发现硫酸庆大霉素片(批号:150801)检验不符合《中华人民共和国药典》(2015年版)标准。
二、福建汇天生物药业有限公司购进使用不符合《中华人民共和国药典》(2015年版)标准的硫酸庆大霉素原料药生产硫酸庆大霉素片并上市销售;伪造、更换硫酸庆大霉素原料药生产企业标签;更换检验样品和留样样品,部分硫酸庆大霉素原料药进厂检验结果不真实;企业关键管理人员直接参与实施违法行为。
从这些描述中可以看出,广西大海阳光“物料发放失误”,发现后却未纠正,随后伪造了一系列单据;福建汇天则从一开始就购进不符合药典标准的原料,为了让劣质原料看起来合格,伪造、更换了原料药生产企业标签,并且连检验样品和留样样品都用已经检验合格的样品替换掉了,而且,企业关键管理人员直接参与违法过程。
在通告中,CFDA给出了几乎一样的处理要求:“国家食品药品监督管理总局要求所有经营、使用单位立即停止销售、使用广西大海阳光药业有限公司(原北海阳光药业有限公司)和福建汇天生物药业有限公司生产的所有硫酸庆大霉素片,并将召回情况报告当地省级食品药品监督管理部门。”并要求“广西壮族自治区、福建省食品药品监督管理局,收回涉事企业的《药品GMP证书》,责令企业召回所有已销售产品,对企业涉嫌违法违规生产行为立案调查,涉嫌犯罪的依法移交公安机关处理。”
可以看出,国家局的文件定性明确,两企业均故意违法,并且,汇天制药关键企业管理人员直接参与及实施违法行为,直指企业的质量管理体系已失效。国家局通告中以召回所有产品、收回GMP证书为指令。
两家企业,两种动作
在违法行为被查处后,两家药企是如何反应的呢?
广西大海阳光:在2017年10月17日-10月19日的飞检过后,2017年11月10日,广西壮族自治区食品药品监督管理局收回了该公司的GMP证书(证书编号:GX20150126),该证书认证范围“片剂、散剂、软膏剂、颗粒剂、硬胶囊剂(含中药前处理和提取)…”。广西壮族自治区监管部门先于国家局通告,一个月内采取了行动,收回了GMP证书,并停止了证书下所有产品的生产。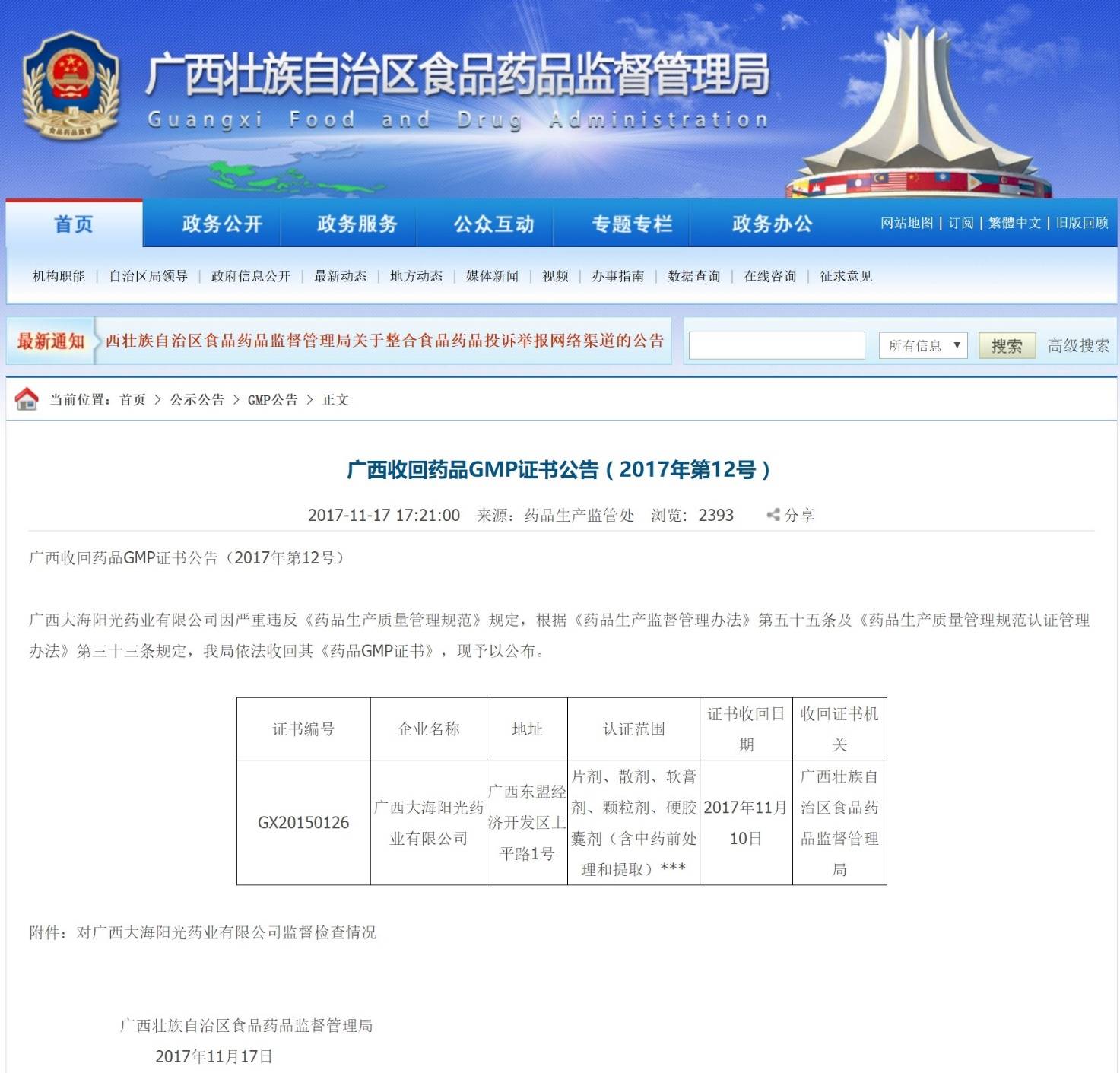
注释: GMP全称Good Manufacturing Practices,意为“生产质量管理规范”,企业(车间)必须达到GMP要求、获得认证才有资格生产药品。GMP证书被收回,意味着该公司无合法生产药品的资格。
福建汇天:这家公司则“运气”比较好。2017年12月29号,在CFDA官网公示出通告的同一天,福建省食品药品监督管理局收回了福建汇天生物药业有限公司片剂《药品GMP证书》(证书编号:FJ20140017)。

对于只收回“片剂”GMP证书的手下留情,汇天制药可谓“反应迅速”,为了保住汇天名下的在售产品,马上进一步寻求地方监管部门的庇护。资料显示,2018年1月2日,元旦后第一个工作日,福建汇天在企业信签上起草了一份企业报告,并且让福建省食品药品监督管理局药品生产监管处为其盖公章。福建汇天自己将这份报告,称为“福建省食品药品监督管理局澄清函”,并在其自己的微信公众号“汇×视界”上进行传播。为自己的违法行为划了一条时间界线:CFDA不查,我没事;CFDA公告,我才认。
而且,该企业工作人员很轻松地对用户说明:GMP证书1个月之后就能拿回来,我们企业在福建搞得定。让我们看到了违法成本的低廉,违法对这家企业而言并不“沉重”,反而很轻松。

探寻屡教不改、屡罚屡犯的根源
其实,这并非福建汇天第一次违法违规,然而每次它都能全身而退。
1、2005年,福建汇天在未取得GMP认证的情况下,未经国家批准就开始生产、销售药品。处罚:福建省三明市药监局责令其限期收回已售出的药品,没收违法所得及未售药品并处以罚款,最后总计罚没款为185280元。
2、2008年,该公司生产的一类原料药不符合标准,在国家药监总局的抽样检查过程中被曝光,被列入2008年第2期国家药品质量公告。
3、2014年,该企业因环境违法,受到三明市环境保护局的行政处罚。
4、2014年,在福建省药监部门的抽样检验中,该公司又被查出硫酸庆大霉素注射液不合格,进入福建省2014年第三季度药品质量公告。
直到2017年的这次违法,该企业已经敢购买不符合药典标准的原料药、换掉样品、伪造原料药生产企业标签,而且,企业管理人员直接参与违法。
为何该企业屡教不改、屡罚屡犯?究其原因,可能是侥幸心理作祟,然而更大的原因却是违法成本过低——无非是罚点钱、公示一下,不过如此。就像父母惯孩子,惯着惯着,汇天从2005年的违规、2008年的劣药,走到了2017年的违法、假药“异途”上。
但药事无小事。曾经,“齐二药”也曾因原料药问题造成9人死亡,《药品生产许可证》被吊销、《药品GMP证书》被收回;上海华联的“甲氨蝶呤”也曾因管理不到位,造成130多位白血病患者瘫痪,最后这家百年药厂不得不关门注销。难道,一定要闹到这种致人死伤的后果,才能得到教训吗?
千年前的《黄帝内经》中记载着一句话“不治已病治未病,不治已乱治未乱”,历经千年检验,是大智慧,值得药品链条上的每一环反思己身。
药品,原本就是人的“性命所托”,应该用最严格的要求来规范、管理。感谢CFDA揪出了这些制造假药、劣药的药企,避免了像2006年“齐二药”、2007年“上海华联甲氨蝶呤”这样致死、致残事件的发生,是一次“治未病”的有效举措。
后续处理结果我们拭目以待!
-
相关阅读



 羊胎素让容颜不老?注
羊胎素让容颜不老?注 李宗瑞不雅照片全集第
李宗瑞不雅照片全集第 第十五届成都国际车展
第十五届成都国际车展 张馨予冯女郎疑炒作喷
张馨予冯女郎疑炒作喷 李晨七夕示爱张馨予 张
李晨七夕示爱张馨予 张






